

一、全球首款口服TYK2变构抑制剂颂狄多(R)中国上市
百时美施贵宝中国近日宣布,全球首个酪氨酸激酶2(TYK2)变构抑制剂颂狄多®(氘可来昔替尼片)在中国上市,为适合系统治疗或光疗的成年中重度斑块状银屑病患者带来兼具长效、安全性与便捷性的口服治疗新方案,这也是目前全球唯一获批的TYK2变构抑制剂。
颂狄多关键III期POETYK PSO-3研究主要研究者、北京大学人民医院皮肤科张建中教授表示:"氘可来昔替尼在中国落地,意味着从此中国皮肤科医生手里多了一个强有力的靶向治疗药物。加上它是一天一片口服,很方便,有助于患者启动和维持规范治疗。未来,期待氘可来昔替尼可以把研究中的亮眼表现延续到真实临床中,切实造福广大中国银屑病患者。"
药物信息
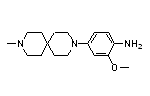
药物名称:Deucravacitinib
适应症:中重度斑块状银屑病
研发公司:百时美施贵宝
API结构
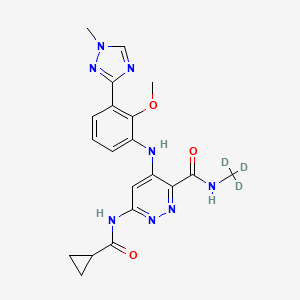
CAS:1609392-27-9
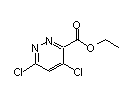
Deucravacitinib结构中韶远能够提供的小分子砌块
SY236298

SY018785

SY253865
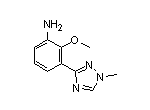
SY102386
二、全球首款心肌肌球蛋白抑制剂玛伐凯泰(Mavacamten)在海南博鳌正式落地
百时美施贵宝中国宣布,全球首款心肌肌球蛋白抑制剂玛伐凯泰(Mavacamten)经海南省药品监督管理局批准,用于治疗有症状的梗阻性肥厚型心肌病(oHCM)成人患者。中国内地首位玛伐凯泰的患者已在上海交通大学医学院附属瑞金医院海南医院(海南博鳌研究型医院)接受了治疗。
作为国内目前唯一的"医疗特区",海南博鳌乐城国际医疗旅游先行区是由国务院批准设立的。国家赋予先行区特许药械政策,允许先行区进口、使用已经在部分国家获批但尚未在国内获批的新药,以此加速满足中国患者和医生对临床急需药物的可及性。
药物信息
药物名称:Mavacamten
适应症:梗阻性肥厚型心肌病(oHCM)
研发公司:百时美施贵宝
API结构

CAS:1642288-47-8
Mavacamten结构中韶远能够提供的小分子砌块
SY129678

SY002236
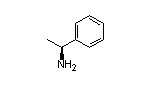
三、卫材治疗痛风新药「多替诺雷」在中国申报上市
近日,中国国家药品监督管理局药品审评中心(CDE)官网公示,卫材中国以注册分类5.1类申报的多替诺雷片上市申请已获得受理1。多替诺雷片(Dotinurad,商品名:优乐思)是一款促尿酸排泄药,此前已经于2020年在日本上市,用于治疗高尿酸血症和痛风2。
痛风是由单钠尿酸盐沉积在关节所致的晶体相关性关节病,目前我国的患病率为1% ~ 3%,并呈逐年上升趋势。痛风除了在急性发作期产生剧烈疼痛,对关节造成损害,还会伴发肾脏病变及其他代谢综合征的表现,如高脂血症、高血压、糖尿病和冠心病等3。过高的血尿酸水平(即高尿酸血症)是发生痛风的最重要的危险因素4。
多替诺雷是一种新型痛风治疗药物,通过选择性抑制与肾脏中尿酸重吸收有关的尿酸盐转运蛋白(URAT1),抑制尿酸重吸收并降低血尿酸水平5。作为一种URAT1选择性抑制剂,多替诺雷有效抑制肾近端小管URAT1而不影响尿酸排泄因子ABCG2和OAT1/3的功能,相比非选择性URAT1抑制剂降血尿酸的效率更高2。
药物信息
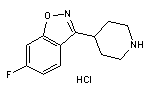
药物名称:Dotinurad
适应症:痛风
研发公司:卫材
API结构
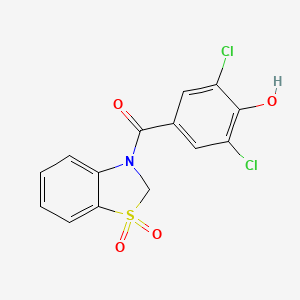
CAS:1285572-51-1
Dotinurad结构中韶远能够提供的小分子砌块
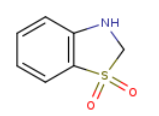
SY002505
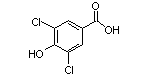
4433-53-8
四、齐鲁制药伊鲁阿克INSPIRE研究登上国际期刊《胸部肿瘤学杂志》
近日,齐鲁制药伊鲁阿克片一线治疗局部晚期或转移性间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌的III期INSPIRE研究中期分析结果在国际肺癌研究协会官方期刊《胸部肿瘤学杂志》(Journal of Thoracic Oncology,IF=20.4)发表。伊鲁阿克INSPIRE研究结果在国际权威期刊的发表,体现了国际学术界对于本项研究成果临床意义的高度认可,也进一步加深学界对INSPIRE研究和伊鲁阿克的认识。
伊鲁阿克是新一代ALK受体酪氨酸激酶抑制剂(TKI),对野生型和突变型ALK融合基因均有抑制作用。这项研究在全国40家中心开展,牵头研究者为中国医学科学院肿瘤医院石远凯教授。研究结果显示,与对照组相比,伊鲁阿克显著延长无进展生存期(PFS),同时显示出更优的颅内抗肿瘤活性。
INSPIRE研究是一项随机、开放、多中心的Ⅲ期临床试验,旨在评估伊鲁阿克与克唑替尼对比在既往未接受过ALK抑制剂治疗的ALK阳性局部晚期或转移性非小细胞肺癌(NSCLC)患者中的疗效与安全性。此前,部分数据在2023年世界肺癌大会上以口头报告形式发表。
药物信息
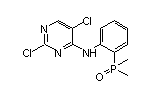
药物名称:lruplinalkib
适应症:肺癌
研发公司:齐鲁制药
API结构
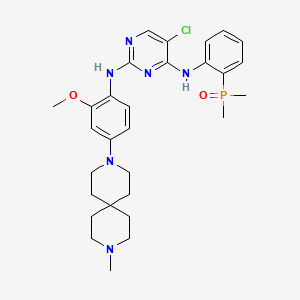
CAS:1854943-32-0
lruplinalkib结构中韶远能够提供的小分子砌块
SY099149
SY243433
五、绿叶制药棕榈酸帕利哌酮缓释混悬注射液在美FDA审评排除专利障碍
绿叶制药集团(2186.HK)于日前更新其棕榈酸帕利哌酮缓释混悬注射液(LY03010)在美国的新药上市审评最新进展。目前,该产品的新药上市申请(NDA)已获得美国食品药品监督管理局(FDA)的受理,且在《美国联邦食品、药品和化妆品法》规定的诉讼时限内未被提起专利侵权诉讼,意味着LY03010项目在FDA审批进程中的专利挑战获得成功。
LY03010是绿叶制药自主研发的创新制剂,用于治疗精神分裂症和分裂情感性障碍。该产品于2023年获得美国发明专利授权,专利将于2039年到期。绿叶制药在美国通过505(b)(2)的途径向FDA提交了LY03010的新药上市申请后,向INVEGA SUSTENNA®的新药持有人和专利权人发送了第四段专利声明(Paragraph IV),根据《美国联邦食品、药品和化妆品法》的规定,新药持有人和专利权人须于收到第四段专利声明后45天内起诉绿叶,才会触发30个月的停滞期。
截至本公告发布时,触发30个月停滞期的起诉期限已届满,绿叶制药并未被提起诉讼,因此LY03010在美国FDA的审批进程无专利障碍。根据处方药申报者付费法案(PDUFA),FDA对于LY03010的上市申请做出决议的目标日期为美国时间2024年7月26日。公司预计将于该产品在美获批上市后第一时间开展在美国的商业化推广。与此同时,LY03010也在中国进入上市审评阶段,并在欧洲开展关键临床试验。
药物信息
药物名称:Paliperidone Palmitate
适应症:精神分裂症和分裂情感性障碍
研发公司:绿叶制药集团
API结构
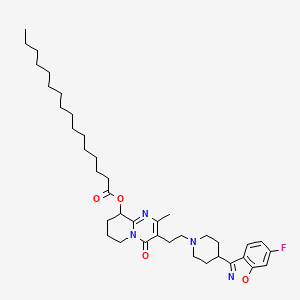
CAS:199739-10-1
Paliperidone Palmitate结构中韶远能够提供的小分子砌块
SY017246
SY019547
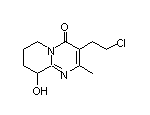
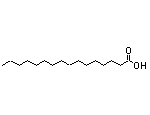
SY006518
六、康宁杰瑞KN046联合白蛋白结合型紫杉醇一线治疗晚期三阴乳腺癌研究结果在Nature子刊全文发表
康宁杰瑞生物制药(股票代码:9966.HK)宣布,PD-L1/CTLA-4双抗KN046联合白蛋白结合型紫杉醇一线治疗晚期三阴乳腺癌的Ⅱ期临床研究结果,近日在国际知名期刊Nature Communications(最新SCI影响因子16.6,JCR 1区)在线发表。中国医学科学院肿瘤医院徐兵河院士为该文通讯作者。
药物信息
药物名称:CTLA-4 inhibitor
适应症:乳腺癌
研发公司:康宁杰瑞生物制药
API结构
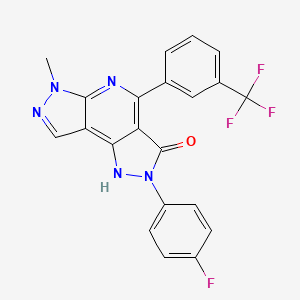
CAS:635324-72-0
CTLA-4 inhibitor结构中韶远能够提供的小分子砌块
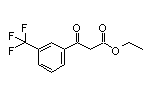
SY065853
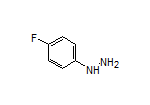
SY004509
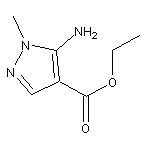
SY122673
关于韶远

ACCELA

【CDMO业务】
电话 50795510(转169,113)
网址 www.accelachem.cn
【试剂业务】
电话 400-066-5055
网址 www.shao-yuan.com
相关推荐
-


2024-03-20
韶远资讯 | 全球小分子药物研发前沿动态(总第119期)
-


2024-03-08
韶远资讯 | 全球小分子药物研发前沿动态(总第118期)
-


2024-02-26
韶远资讯 | 全球小分子药物研发前沿动态(总第117期)
-


2024-02-04
韶远资讯 | 全球小分子药物研发前沿动态(总第116期)
-


2024-01-18
韶远资讯 | 全球小分子药物研发前沿动态(总第115期)
-


2024-01-06
韶远资讯 | 全球小分子药物研发前沿动态(总第114期)
-


2023-12-14
韶远资讯 | 全球小分子药物研发前沿动态(总第113期)
-


2023-12-07
韶远资讯 | 全球小分子药物研发前沿动态(总第112期)




