

一、百济神州BTK抑制剂百悦泽®(泽布替尼)在中国获批滤泡性淋巴瘤适应症
百济神州(纳斯达克代码:BGNE;香港联交所代码:06160;上交所代码:688235)是一家全球肿瘤治疗创新公司,今日宣布,其BTK抑制剂泽布替尼(中文商品名:百悦泽®;英文商品名:BRUKINSA®)获得中国国家药品监督管理局(国家药监局)附条件批准注册,新增以下适应症:联合奥妥珠单抗,适用于既往接受过至少二线系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。
此次泽布替尼获得国家药监局的附条件批准,是基于一项全球性、随机、开放、多中心的2期研究ROSEWOOD试验(NCT03332017),该研究旨在比较泽布替尼联合奥妥珠单抗和奥妥珠单抗单药治疗在217例既往接受过至少二线系统性治疗的复发或难治性FL患者中的治疗效果。该适应症后续的常规批准将取决于确证性临床试验,即一项在复发/难治性滤泡性或边缘区淋巴瘤患者中比较泽布替尼联合抗CD20抗体与来那度胺联合利妥昔单抗的3期随机对照研究(BGB-3111-308)的临床试验结果。
药物信息
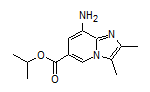
药物名称:Zanubrutinib
适应症:肿瘤
研发公司:百济神州
API结构
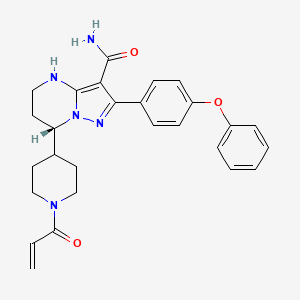
CAS:1691249-45-2
Zanubrutinib结构中韶远能够提供的小分子砌块
SY024939
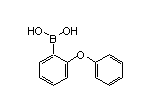
SY323126
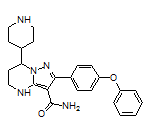
二、绿叶制药创新制剂利斯的明透皮贴剂(2次/W)在日本进入新药上市申请阶段,治疗阿尔茨海默病相关痴呆症
绿叶制药集团宣布,其合作伙伴Towa Pharmaceutical Co., Ltd.(东和药品)已向日本厚生劳动省递交利斯的明透皮贴剂(2次/W)的新药上市申请,用于治疗与阿尔茨海默病相关的轻、中度痴呆症。
利斯的明透皮贴剂(2次/W)基于绿叶制药的透皮释药技术平台自主开发,通过创新的给药途径经皮肤给药,是一周两次的利斯的明创新贴剂剂型。2020年12月,绿叶制药与东和药品达成协议,授予后者该产品在日本市场的独家开发及商业化权利。
此项新药上市申请基于东和药品在日本完成的一项治疗阿尔茨海默病相关痴呆症的Ⅲ期临床试验的中期分析结果。该项临床研究已达到主要疗效终点。
药物信息
药物名称:Rivastigmine
适应症:与阿尔茨海默病相关的轻、中度痴呆症
研发公司:绿叶制药
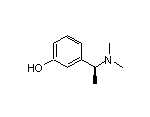
API结构
CAS:123441-03-2
Rivastigmine结构中韶远能够提供的小分子砌块
SY002124
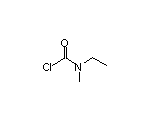
SY067144
三、【EHA 2024】亚盛医药重磅品种的五项研究进展入选2024年欧洲血液学协会年会
致力于在肿瘤、乙肝及与衰老相关疾病等治疗领域开发创新药物的领先的生物医药企业——亚盛医药(6855.HK)今日宣布,公司三个重要品种的五项最新研究进展入选2024年欧洲血液学协会年会(EHA 2024)壁报,涉及的品种分别为中国首个且唯一获批上市的第三代BCR-ABL抑制剂奥雷巴替尼(HQP1351;商品名:耐立克®)、Bcl-2选择性抑制剂APG-2575和EED选择性抑制剂APG-5918。
欧洲血液学协会(EHA)年会作为欧洲血液学领域规模最大的国际会议,每年吸引来自全球100多个国家的1万多名专业人士与会,分享全球最前沿的研究进展和突破性临床数据。本届EHA年会将于2024年6月13日至16日在西班牙马德里举行。
药物信息
药物名称:Olverembatinib
适应症:肿瘤
研发公司:亚盛医药
API结构
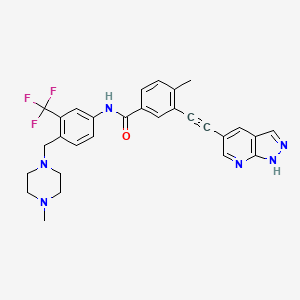
CAS:1257628-77-5
Olverembatinib结构中韶远能够提供的小分子砌块
SY012662
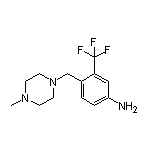
SY070759
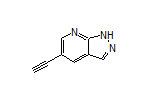
SY259619
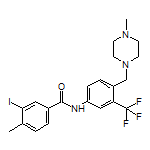
SY242501
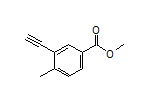
SY006972
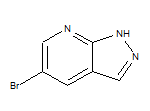
四、鼎优乐®(舒巴坦钠-度洛巴坦钠)获中国国家药监局批准上市
再鼎医药有限公司(纳斯达克股票代码:ZLAB;香港联交所股份代号:9688)和Innoviva Specialty Therapeutics今日宣布,中国国家药品监督管理局已经批准了鼎优乐®(舒巴坦钠-度洛巴坦钠,SUL-DUR)的新药上市申请,用于治疗18岁及以上患者由鲍曼-醋酸钙不动杆菌复合体敏感分离株所致医院获得性细菌性肺炎(HABP)、呼吸机相关性细菌性肺炎(VABP)。世界卫生组织认为不动杆菌是亟需新型抗生素的病原体之一[1]。
再鼎医药总裁,中枢神经系统、自身免疫及感染性疾病领域全球开发负责人任海睿博士表示:“舒巴坦钠-度洛巴坦钠获得中国国家药监局的批准,凸显了再鼎致力于开发和提供创新疗法,以满足中国和全球患者的未满足的医疗需求。对于耐药不动杆菌感染对公众的威胁,我们亟需采取行动,因为患者的治疗选择有限,死亡率高。我们坚信舒巴坦钠-度洛巴坦钠的获批代表了我们在患者存在巨大需求的领域又向前迈进了一步。”
药物信息
药物名称:Sulbactam Sodium
适应症:肺炎
研发公司:再鼎医药
API结构
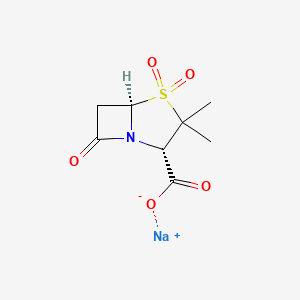
CAS:69388-84-7
Sulbactam Sodium结构中韶远能够提供的小分子砌块
SY076847
五、【2024 ASCO】亚盛医药公布多项临床进展,再证全球化创新与开发实力
中国苏州和美国马里兰州罗克维尔市2024年5月24日 /美通社/ -- 致力于在肿瘤、乙肝及与衰老相关疾病等治疗领域开发创新药物的领先生物医药企业——亚盛医药(6855.HK)今日宣布,公司四项入选2024年美国临床肿瘤学会(ASCO)年会的临床研究的摘要已于ASCO官网公布,涉及中国首个获批上市的第三代BCR-ABL抑制剂奥雷巴替尼(研发代号:HQP1351;商品名:耐立克®)、Bcl-2选择性抑制剂APG-2575和FAK/ALK/ROS1三联抑制剂APG-2449三个重点品种。
这四项临床研究的最新进展将于2024年5月31日至6月4日(美国当地时间)举办的ASCO年会上以口头报告或壁报的形式展示。一年一度的ASCO年会是全球肿瘤领域最重要的、最为权威的学术交流盛会,将展示当前国际最前沿的临床肿瘤学科研成果和肿瘤治疗技术。
药物信息
药物信息
药物名称:Lisaftoclax(APG-2575)
适应症:肿瘤
研发公司:亚盛医药
API结构
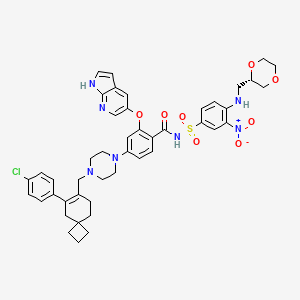
CAS:2180923-05-9
Lisaftoclax结构中韶远能够提供的小分子砌块
1628174-84-4
SY004898
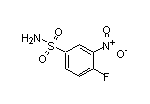
SY035251
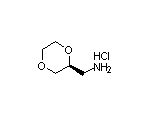
2180923-64-0
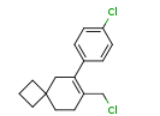
2180923-63-9
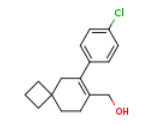
2180923-62-8
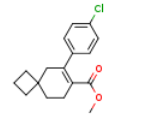
2180923-73-1
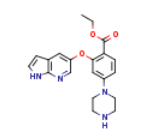
2169699-38-9
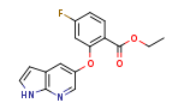
SY030452
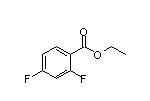
SY125554
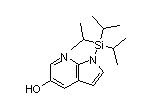
SY002528
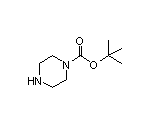
SY004529
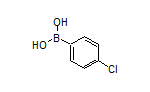
2180923-60-6
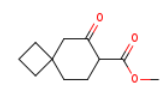
SY330904
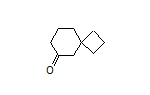
六、Onconic Therapeutics在2024美国消化疾病周公布JAQBO的3期积极结果
致力于开发肿瘤和胃肠道疾病创新疗法的临床阶段生物制药公司Onconic Therapeutics在2024年5月18日至21日在华盛顿特区举行的2024美国消化疾病周(DDW)上公布了JAQBO(zastaprazan柠檬酸盐)的3期ZERO-1研究结果。
韩国Eunpyeong St. Mary's Hospital教授兼胃肠病学家、ZERO-1研究的主要作者Jung-hwan Oh博士在口头报告会上介绍了3期试验结果。这项随机、双盲、主动对照研究比较了zastaprazan与埃索美拉唑在糜烂性食管炎患者中的疗效和安全性。参与者每天接受20毫克zastaprazan或40毫克埃索美拉唑,持续长达八周。在300名招募患者中,研究表明,zastaprazan组在第8周的累积愈合率为97.9%,而埃索美拉唑组为94.9%。到第 4 周,zastaprazan的愈合率为 95.1%,而埃索美拉唑的愈合率为 87.7%,差异有统计学意义。这些结果证实zastaprazan不劣于埃索美拉唑。此外,zastaprazan在一小时内起效迅速,并且24小时内胃内pH值保持在4以上的时间达到85%,突出了其有效缓解夜间胃酸反流症状的潜力及其持久的功效。
药物信息
药物名称:Zastaprazan
适应症:糜烂性食管炎
研发公司:Onconic Therapeutics
API结构
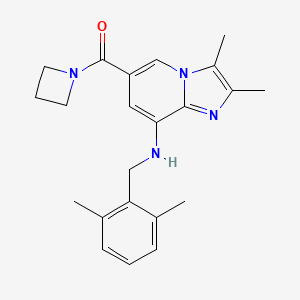
CAS:2133852-18-1
Zastaprazan结构中韶远能够提供的小分子砌块
SY008884
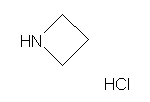
SY017107
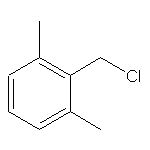
SY320420
关于韶远

ACCELA

【CDMO业务】
电话 50795510(转169,113)
网址 www.accelachem.cn
【试剂业务】
电话 400-066-5055
网址 www.shao-yuan.com










