

一、加科思KRAS G12C抑制剂注册性试验数据到达主要研究终点
加科思药业(1167.HK)宣布,其自主研发的KRAS G12C抑制剂glecirasib的二期注册性临床数据于线上举行的4月ASCO全体系列(Asco Plenary Series)正式公布。
中国医学科学院肿瘤医院主任医师石远凯教授作为此项临床试验的首席主要研究者,以线上口头报告的形式公布这项数据(摘要编号 468214)。
从有效性来看,在单药二线非小细胞肺癌患者中,确认客观缓解率(ORR)为47.9%(56/117),其中包括4例患者实现完全缓解(CR),36例患者肿瘤缩小超过50%,疾病控制率为86.3%。
中位无进展生存期(mPFS)为8.2个月,中位总生存期(mOS)为13.6个月。中位缓解持续时间(mDoR)数据还未成熟,6个月和12个月的缓解持续时间比例分别为73.6%和56.6%。
从安全性数据来看,戈来雷塞有良好的安全性特征。无五级副反应,仅有5%的患者停药。和其他KRAS G12C抑制剂相比,具有良好的消化道安全性特征。
药物信息
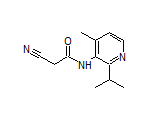
药物名称:Glecirasib
适应症:肺癌
研发公司:加科思药业
API结构
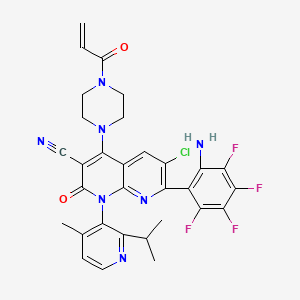
CAS:2657613-87-9
Glecirasib结构中韶远能够提供的小分子砌块
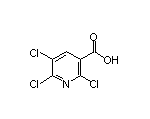
2657617-90-6
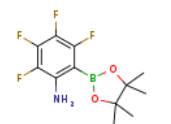
SY002528
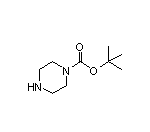
2400937-64-4
SY323354
SY034400
二、云顶新耀宣布中国澳门药物监督管理局批准伊曲莫德(VELSIPITY®)用于治疗中重度活动性溃疡性结肠炎的新药上市许可申请
云顶新耀(HKEX 1952.HK)是一家专注于创新药及疫苗研发、临床开发、制造和商业化的生物制药公司,今日宣布中国澳门特别行政区药物监督管理局已正式批准伊曲莫德(VELSIPITY®, etrasimod)用于治疗中重度活动性溃疡性结肠炎成人患者的新药上市许可申请。澳门成为伊曲莫德在云顶新耀亚洲授权区内第一个获得批准的地区。伊曲莫德是一款每日一次口服的一线先进疗法不仅使用方便、疗效佳,而且具有良好的安全性特征。伊曲莫德已于去年10月和今年2月先后在美国和欧盟获得新药上市批准,并成为欧盟首个且唯一获批用于16岁及以上患者的新一代口服治疗溃疡性结肠炎药物。
药物信息
药物名称:Etrasimod
适应症:结肠炎
研发公司:云顶新耀
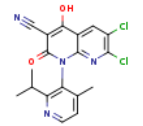
API结构
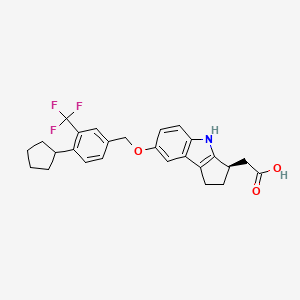
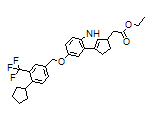
CAS:1206123-37-6
Etrasimod结构中韶远能够提供的小分子砌块
SY375565
三、利奥制药宣布Enstilar®(LEO90100)在中国开展的III期临床试验的Topline结果显示,Enstilar®在患有稳定性斑块状银屑病的中国成人受试者中表现出优效性
在患有稳定性斑块状银屑病的中国成人受试者中表现出优效性
利奥制药作为医学皮肤科的全球领导者,于5月7日宣布了Enstilar®在中国稳定性斑块状银屑病成人患者中开展的III期临床试验的积极结果。
该临床试验是一项在中国稳定性斑块状银屑病成人受试者中比较Enstilar®(LEO90100)和得肤宝®(卡泊三醇倍他米松软膏)(每日使用一次,为期4周)的有效性和安全性的多中心、随机、研究者设盲、活性药物对照、平行分组的III期临床试验。在中国的39个研究中心共计招募了604名患者。
该研究的主要目的是评估Enstilar®(LEO 90100)相较于得肤宝®(卡泊三醇倍他米松软膏)在治疗稳定性斑块状银屑病的有效性。次要目的是评估治疗的安全性。探索性目的包括评估健康相关生活质量。1
Topline结果表明,Enstilar®在主要终点上相较于得肤宝®(卡泊三醇倍他米松软膏)表现出优效性。
药物信息
药物名称:Enstilar
适应症:银屑病
研发公司:利奥制药
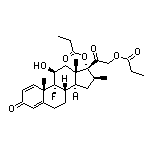
API结构
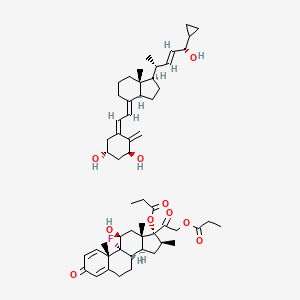
CAS:485805-18-3
Enstilar结构中韶远能够提供的小分子砌块
SY060124
四、头对头优效于高剂量度拉糖肽,玛仕度肽首个糖尿病III期临床研究达成研究终点
信达生物制药集团(香港联交所股票代码:01801),一家致力于研发、生产和销售肿瘤、自身免疫、代谢及心血管、眼科等重大疾病领域创新药物的生物制药公司,今日宣布胰高血糖素样肽-1受体(GLP-1R)/胰高血糖素受体(GCGR)双重激动剂玛仕度肽(研发代号:IBI362)在中国2型糖尿病受试者开展的III期临床研究(DREAMS-2)达到首要终点。研究结果提示玛仕度肽降糖疗效显著优于度拉糖肽,并在减重、血脂、血压、血尿酸、肝酶等代谢指标均展示出了更优越的综合获益。
药物信息
药物名称:GCGR antagonist 2
适应症:糖尿病
研发公司:信达生物制药集团
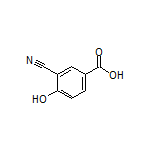
API结构
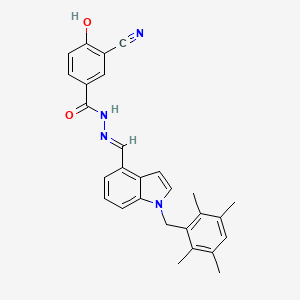
CAS:280134-25-0
GCGR antagonist 2结构中韶远能够提供的小分子砌块
SY104313
219685-85-5
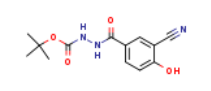
219685-69-5
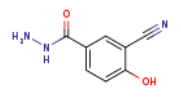
SY013097
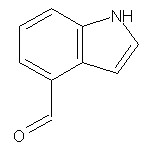
SY010705
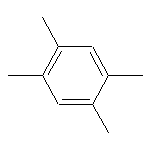
7435-83-8
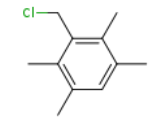
490038-36-3
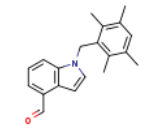
五、卫材抗癫痫药物吡仑帕奈片新适应症获得国家药品监督管理局批准
近日,卫材原研抗癫痫药物(AED)吡仑帕奈(中文商品名:卫克泰®,英文商品名:Fycompa®)在华新适应症获得国家药品监督管理局批准,用于成人和12岁及以上儿童癫痫和原发性全面性强直-阵挛发作患者的加用治疗。
卫克泰是由卫材筑波研究实验室研发的Frist-in-Class抗癫痫药物,一种高度选择性、非竞争性的AMPA受体拮抗剂,减少与癫痫发作相关的神经元的过度兴奋。
卫克泰于2019年9月通过优先审评,获批用于成人和12岁及以上儿童癫痫部分性发作患者(伴有或不伴有继发性全面性癫痫发作)的加用治疗。2020年10月,国家药品监督管理局受理其单药治疗和4岁及以上儿科患者的部分性癫痫发作适应症的申报,并于2021年7月获得批准。2023年5月在中国获批口服混悬液剂型,用于成人和4岁及以上儿童癫痫部分性发作患者(伴有或不伴有继发全面性发作)的治疗,口服混悬液剂型与口服片剂适应症一致,同时将更适合于吞咽障碍和儿科患者的使用。另外,2020年12月卫克泰已被正式纳入中国《国家基本医疗保险、工伤保险和生育保险药品目录(2020年版)》。
药物信息
药物名称:Fycompa
适应症:癫痫
研发公司:卫材
API结构
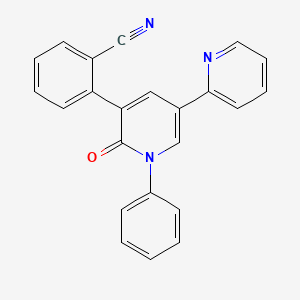
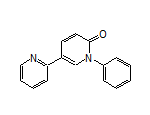
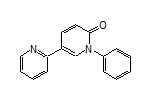
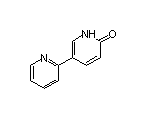
CAS:380917-97-5
Fycompa结构中韶远能够提供的小分子砌块
SY258272
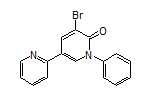
SY051086
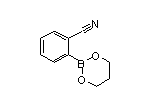
SY310387
SY310387
SY033084
六、奥凯乐® (瑞普替尼)获中国国家药监局批准,用于治疗ROS1阳性非小细胞肺癌患者
再鼎医药(纳斯达克代码:ZLAB;香港联交所股份代号:9688)宣布,奥凯乐® (瑞普替尼)已获中国国家药品监督管理局(NMPA)批准,用于治疗ROS1阳性的局部晚期或转移性非小细胞肺癌成人患者。该批准基于TRIDENT-1关键研究,这是一项开放标签、单臂的1/2期研究,在TKI初治患者和接受过TKI治疗的ROS1阳性非小细胞肺癌患者中评估了瑞普替尼。
再鼎医药总裁兼全球肿瘤研发负责人Rafael G. Amado博士表示,"我们很高兴NMPA批准了瑞普替尼,用于治疗中国的ROS1阳性非小细胞肺癌患者。考虑到现有疗法会出现耐药并最终导致肿瘤进展,患者获益的持续时间有限,他们存在着巨大的未被满足的需求。我们感谢中国国家药品监督管理局对瑞普替尼的全面评估,认可其解决中国未被满足的医疗需求的潜力。"
药物信息
药物名称:Ripretinib
适应症:肺癌
研发公司:再鼎医药
API结构
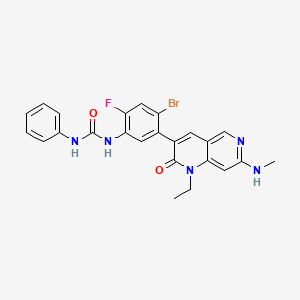
CAS:1442472-39-0
Ripretinib结构中韶远能够提供的小分子砌块
SY001495
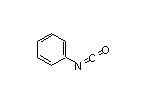
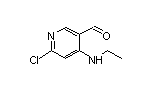
SY225730
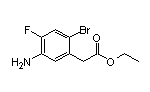
SY061004
关于韶远

ACCELA

【CDMO业务】
电话 50795510(转169,113)
网址 www.accelachem.cn
【试剂业务】
电话 400-066-5055
网址 www.shao-yuan.com












