

一、首张处方丨 四川大学华西乐城医院开出国内首张特许药品——醋酸艾司利卡西平处方,为癫痫患者提供治疗新选择!
位于乐城先行区的四川大学华西乐城医院开出特许药品醋酸艾司利卡西平全国首张处方为癫痫患者带来治疗新选择!
得益于海南省卫健委、海南省药监局及中国抗癫痫协会等各方的支持,醋酸艾司利卡西平借助博鳌乐城“先行先试”政策,在四川大学华西乐城医院成功落地。这是该院首个特许新药项目,同时该处方也是四川大学华西乐城医院的首张处方。
醋酸艾司利卡西平作为一种新型的电压门控式钠通道阻滞剂,在前期的临床研究和国外的实践经验中,治疗局灶性癫痫发作疗效确切,且安全性和耐受性良好。目前,该药未在国内引进上市,患者可通过四川大学华西乐城医院特许申请,还能结合医嘱将适量自用口服药物带离院区使用。
药物信息
药物名称:Eslicarbazepine acetate
适应症:癫痫
研发公司:Bial-Portela、卫材(Eisai)和大日本住友(Dainippon Sumitomo)公司联合开发
API结构
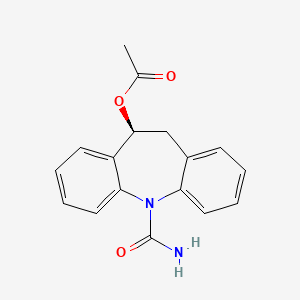
CAS:236395-14-5
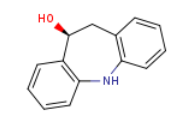
Eslicarbazepine acetate结构中韶远能够提供的小分子砌块
SY109227

1431547-14-6
二、中国国家药品监督管理局批准安可坦(XTANDI,恩扎卢胺)治疗转移性激素敏感性前列腺癌的新适应症
安斯泰来制药集团(TSE:4503,总裁兼首席执行官:冈村直树,"安斯泰来")近日宣布,中国国家药品监督管理局(NMPA)药品审评中心(CDE)已批准安可坦(XTANDI,恩扎卢胺)用于治疗转移性激素敏感性前列腺癌(mHSPC)的适应症。
这项批准基于全球III期ARCHES研究和中国ARCHES研究的积极结果。中国ARCHES研究使用替代终点(PSA进展时间)来桥接全球ARCHES研究结果。在中国ARCHES研究中,180名中国大陆的mHSPC患者随机接受恩扎卢胺联合ADT治疗,或者安慰剂联合ADT治疗。结果显示,与安慰剂联合ADT相比,恩扎卢胺联合ADT显著降低了PSA进展风险87%(风险比为 0.130 [95% CI 0.076, 0.222]; P<0.0001)。影像学无进展生存期(rPFS)、至去势抵抗时间(TTCR)和PSA不可测率等次要终点,恩扎卢胺联合ADT治疗组也优于安慰剂联合ADT组的治疗。这些研究发现再次显示出恩扎卢胺的积极结果,与全球III期ARCHES研究保持一致。中国ARCHES研究中,恩扎卢胺联合ADT治疗的安全性与已知的安全性一致。总体而言,这些发现支持恩扎卢胺在治疗中的早期应用。
药物信息
药物名称:Enzalutamide
适应症:转移性激素敏感性前列腺癌
研发公司:安斯泰来
API结构
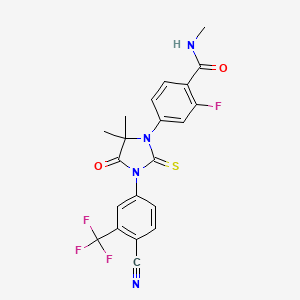
CAS:915087-33-1
Enzalutamide结构中韶远能够提供的小分子砌块
SY039781
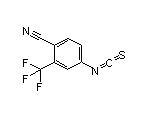
SY116162

三、创新药给心肌"减肥" 靶向青少年和运动员心脏性猝死最常见病因
近日,由中国生物医药公司箕星制药开发的治疗肥厚心肌病的第二代靶向药物Aficamten治疗症状性梗阻性肥厚型心肌病的疗效和安全性的关键 3期临床研究SEQUOIA-HCM的完整数据结果在国际顶尖医学期刊《新英格兰医学》发表。今年4月30日,第一代治疗肥厚心肌病的心肌肌球蛋白抑制剂在国内获批治疗梗阻性肥厚型心肌病。这两款针对HCM病因开发的创新药同时"亮剑",意味着肥厚型心肌病的治疗已进入靶向治疗时代。
药物信息
药物名称:Aficamten
适应症:症状性梗阻性肥厚型心肌病
研发公司:箕星制药
API结构
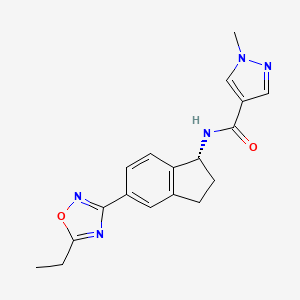
CAS:2364554-48-1
Aficamten结构中韶远能够提供的小分子砌块
SY014144
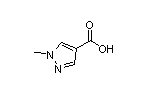
SY039489
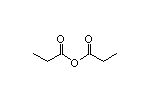
SY389515
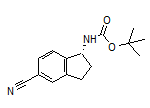
四、安进获得首创新药TAVNEOS®(阿伐可泮)的商业化权益
近日,安进与CSL Vifor公司达成协议,获得TAVNEOS® ( 阿伐可泮) 在亚洲和拉丁美洲地区的商业化权益,其中包括中国内地市场。TAVNEOS®(阿伐可泮)是一款治疗中性粒细胞胞质抗体(ANCA)相关血管炎的药物,是具有变革性意义的同类首创药物。
ANCA相关血管炎,是一组罕见的血管炎症性疾病,可能导致器官功能受损。ANCA相关血管炎年发病率约为10–20 /百万,中国住院患者中现患率为0.25‰。如果不治疗,80%的患者将在诊断后两年内死亡[2]。安进副总裁兼中国总经理许蔼龄女士表示:" TAVNEOS® (阿伐可泮)是安进的一个重要增长产品,我们期待它尽快在中国获批上市,能够为更多患有自身免疫性疾病的患者提供服务。把更多创新产品带到中国,造福患者,是我们对中国市场长期不变的承诺。"
TAVNEOS®(阿伐可泮)于2021年10月获得美国食品药品监督管理局(FDA)批准上市,用于治疗成人活动性严重ANCA相关血管炎(MPA和GPA)的辅助治疗,用于并联合包括糖皮质激素在内的标准治疗方案(阿伐可泮不能消除糖皮质激素的使用)。 目前已经在美国,加拿大,澳大利亚,英国,德国,阿联酋,日本和韩国8个国家获得上市批准。
药物信息
药物名称:Avacopan
适应症:中性粒细胞胞质抗体(ANCA)相关血管炎
研发公司:CSL Vifor
API结构
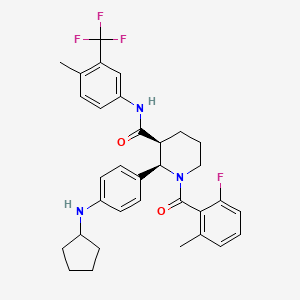
CAS:1346623-17-3
Avacopan结构中韶远能够提供的小分子砌块
SY016125
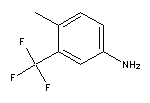
SY002830
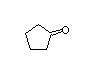
SY239717

SY078786
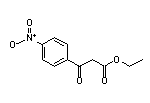
SY003526
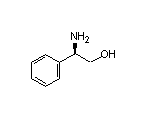
SY015350
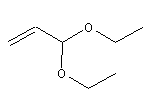
五、和黄医药宣布他泽司他 (tazemetostat) 用于治疗复发或难治性滤泡性淋巴瘤的中国新药上市申请获受理并获纳入优先审评
和黄医药(中国)有限公司(简称"和黄医药"或"HUTCHMED")(纳斯达克/伦敦证交所:HCM;香港交易所:13)近日宣布他泽司他(tazemetostat)用于治疗复发或难治性滤泡性淋巴瘤成人患者的新药上市申请已获中国国家药品监督管理局("国家药监局")受理并予以优先审评。
他泽司他是由益普生(Ipsen)旗下公司Epizyme, Inc.("Epizyme")开发的全球同类首创的EZH2甲基转移酶抑制剂,已获美国食品药品监督管理局("FDA")加速批准用于治疗特定的复发/难治性滤泡性淋巴瘤患者以及特定的晚期上皮样肉瘤患者。日本厚生劳动省亦已批准其用于治疗特定的复发/难治性滤泡性淋巴瘤患者。和黄医药达成一项战略合作,负责在中国内地、香港、澳门和台湾进行他泽司他的研究、开发、生产以及商业化。
一项在中国开展的多中心、开放标签的II 期桥接研究,以及 Epizyme 在中国以外地区开展的临床研究支持了此项中国新药上市申请。
药物信息
药物名称:Tazemetostat
适应症:复发或难治性滤泡性淋巴瘤
研发公司:和黄医药
API结构
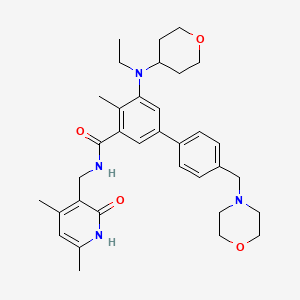
CAS:1403254-99-8
Tazemetostat结构中韶远能够提供的小分子砌块
SY021924

SY040987
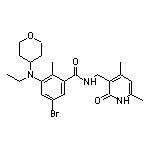
SY023498
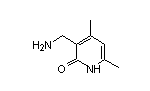
SY126273
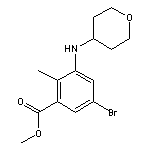
SY016738

六、绿叶制药镇痛药米美欣®(羟考酮纳洛酮缓释片)在中国获批上市
绿叶制药集团(2186.HK)宣布,其经多年研发的镇痛药——米美欣®(羟考酮纳洛酮缓释片)已于2024年6月28日获得中国国家药品监督管理局的上市批准,适用于成人需阿片类镇痛药才能充分控制的重度疼痛(癌痛和非癌痛)。米美欣®的优势是加入阿片受体拮抗剂纳洛酮,通过阻断羟考酮对肠道阿片受体的作用来缓解阿片类药物引起的便秘症状(opioid-induced constipation,OIC)。
我国对于麻醉药品和精神药品的研制和生产具有严格的管理制度,研制和定点生产企业的资质均需经过批准且实行总量控制,准入门槛高。米美欣®是当前唯一一款在国内获批上市的、具有高技术壁垒的国产羟考酮纳洛酮缓释片。通过强阿片受体激动剂羟考酮、阿片受体拮抗剂纳洛酮的联合作用,米美欣®在帮助患者控制疼痛的同时,有效降低阿片类药物引起的便秘,单次用药镇痛时间可维持12小时;此外,米美欣®的独特"锁药"技术可有效防止药物滥用。
药物信息
药物名称:Naloxone
适应症:重度疼痛(癌痛和非癌痛)
研发公司:绿叶制药
API结构
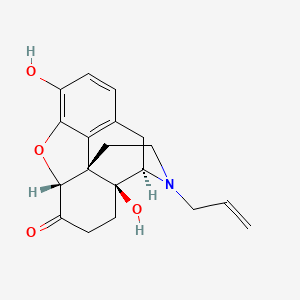
CAS:465-65-6
Naloxone结构中韶远能够提供的小分子砌块
SY370888
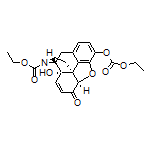
SY371177
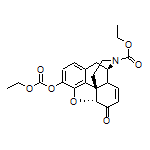
SY371231

SY233209
关于韶远

ACCELA

【CDMO业务】
电话 50795510(转169,113)
网址 www.accelachem.cn
【试剂业务】
电话 400-066-5055
网址 www.shao-yuan.com










